Ультраструктура тканей пародонта верхней челюсти и изменения некоторых показателей общей и местной неспецифической резистентности у пациентов через 6 месяцев после проведения синус-лифтинга

В настоящее время распространенными методами замещения костного дефекта является синус-лифтинг. Чаще всего он необходим для качественной установки зубных имплантатов в боковые отделы верхней челюсти в условиях недостаточного объема кости. Процессы остеорегенерации у пациентов с атрофией альвеолярного отростка верхней челюсти, которым было проведено синус-лифтинг, учитывая особенности и плотности строения кости и интенсивность кровоснабжения костной ткани активно происходят в течение 6 месяцев [1,3]. Считают, что именно в этот период после остеозамищения остеопластическим материалом практически завершается формирование новой кости, прорастание капилляров и восстановления большинства гомеостатических параметров ротовой полости [23]. Однако, говорить о том, что механизмы, которые отвечают за ход восстановительных процессов, раскрыты полностью в настоящее время является преждевременным [18].
В течение длительного времени в клинической практике в качестве костно-пластических материалов применялись три вида костных трансплантатов: аутогенные, аллогенные и ксеногенные, которые способны обеспечивать направленную костную регенерацию [22]. В стоматологической практике часто применяют натуральный остеозаменяющий материал Bio-Oss, который состоит из минеральных компонентов бычьей кости. Исследователи и клиницисты считают, что биоматериалы природного происхождения могут оказывать положительное влияние на адгезию клеток, заживление ран и регенерацию тканей, а также служить матрицей для новой ткани, которая формируется [20,23]. Однако на сегодняшний день можно утверждать, что еще не существует "идеального материала", который бы отвечал всем требованиям и полностью обеспечивал неосложненный ход формирования кости.
Целью работы было исследование структуры и функции тканей пародонта, местной неспецифической резистентности в полости рта и активности щелочной фосфатазы у пациентов с атрофией альвеолярного отростка верхней челюсти через 6 месяцев после проведения синус-лифтинга.
Материалы и методы исследования.
С целью формирования репрезентативной группы пациентов для выполнения работы проведено комплексное обследование 127 человек обоего пола в возрасте 35-55 лет без пародонтита или с пародонтитом I-й степени с атрофией альвеолярного отростка верхней челюсти, вызванной экстракции зубов. На ортопантомограмме проявляли частичную адентию без очагов хронического периодонтита но с выраженной деструкцией альвеолярного отростка верхней челюсти в области моляров (высота альвеолярного отростка составила 2 - 4 мм).
Всем пациентам перед операцией синус-лифтинга, проводилась оценка функционального состояния организма с применением общепринятых методов предоперационной подготовки. Рентгенологическое обследование включало изучение прицельных снимков челюстных сегментов, в том числе окклюзионных ортопантомограмм, которые проводили с помощью цифрового ортопантомографа Planmeca ProOne (Финляндия).
Реконструкцию альвеолярного отростка и тела верхней челюсти выполняли доступом через дистально-латеральную стенку с поднятием дна верхнечелюстной пазухи [13]. В качестве костно-пластического материала применяли натуральный остеозаминяющий биоматериал BioOss (Geistlich Biomaterials, Швейцария), который состоит из минеральных компонентов бычьей кости и представляет собой надежный каркас для прорастания кровеносных сосудов и миграции остеобластов из костных стенок, которые окружают костный дефект, что облегчает формирование и прорастания новой кости [20,23].
В морфологических и морфометрических исследованиях использовали образцы прикрепленной десны и кости верхней челюсти. Препараты для электронно-микроскопических исследований изготавливали по общепринятой методике с предварительной декальцинации образцов кости альвеолярного отростка [7]. Фиксацию биологического материала проводили с помощью забуференного 2,5% раствора глютарового альдегида и реактива Колфилда (на основе 2% OsO4, pH – 7,3) с последующей заливкой в эпон (реактивы фирмы Sigma, США). Ультратонкие срезы толщиной 40-60 мм контрастировали с 1% раствором уранил ацетата и раствором цитрата свинца по методике Рейнольдса (реактивы фирмы Sigma, США) [15] и исследовали с помощью электронного микроскопа ПЭМ-125К (Украина).
Морфометрическую оценку гистогематического барьера (ГГБ) в ткани прикрепленной десны выполняли на электронных микрофотографиях согласно подходами Вейбеля [4], определяя среднюю арифметическую толщину барьера (τ). Общее количество функционирующих капилляров определяли по методике Hoppeler H. и др. [19] на экране электронного микроскопа при малом увеличении (х 1800-2000). Общее количество митохондрий (nМХ) определяли с помощью компьютерной программы Image Tool Version 3 (США) на 130-150 полях для каждой серии исследований.
Исследование количества нейтрофильных лейкоцитов (НЛ), эмигрировавших в ротовую полость через слизистую оболочку щеки, выполняли в соскобах, отобранных в соответствии с методикой, предложенной В.Д.Дишловим [5]. Соскобы (мазки) фиксировали в метиловом спирте, красили раствором (1 мл готового красителя + 2 мл основного буферного раствора + 47 мл дистиллированной воды) в течение 40 мин. Ядра нейтрофилов были окрашены в цвета от интенсивно пурпурного до фиолетового, цитоплазма - в сине-голубой цвет [14,16]. Подсчитывали количество нейтрофилов на 100 клеток с помощью светового микроскопа (иммерсия, х90) (Karl Zeiss, Германия).
Определение активности щелочной фосфатазы (ЛФ) нейтрофильных лейкоцитов проводили методом азотосоединения с замещением нафтолом за Акерманом [5,11]. Для оценки цитохимической реакции применяли метод Kaplow L.S. [26].
Определение активности щелочной фосфатазы плазмы крови определяли фотоколориметрическим методом с помощью фотоэлектроколориметра (ФЭК - AE-30F, Россия) [11].
Количественное определение костного изофермента щелочной фосфатазы - остазы (ОС) для оценки активности остеобластов, выполняли в образцах плазмы крови методом иммуноферментного анализа с помощью наборов METRA® BAP (Quidel corporation, США). Измерения выполняли планшетным фотометром для иммуноферментного анализа УНИПЛАН (Пикон, Россия).
Статистический анализ полученных данных проводили с использованием пакета прикладных программ (пакет анализа Мicrosoft Office Excel (2003)). Р <0,05 изменения считали достоверными.
Результаты исследования и их обсуждение.
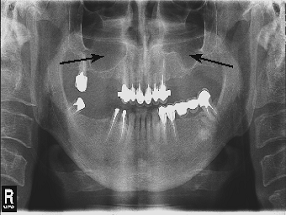
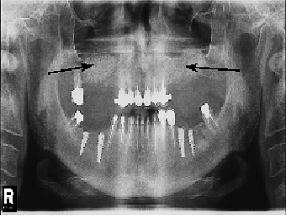
При анализе ортопантомограммы через 6 месяцев после проведения синус-лифтинга в участках, в которых наблюдалась атрофия альвеолярного отростка верхней челюсти, которая устранялась с помощью биоматериала BioOss визуально определялось ремоделирования кости (рис. 1б), то есть через полгода после операции синус-лифтинга происходило восстановление альвеолярного отростка верхней челюсти. Однако, структура регенерированной кости не может считаться полностью идентичной кости здоровых лиц (рис. 2).
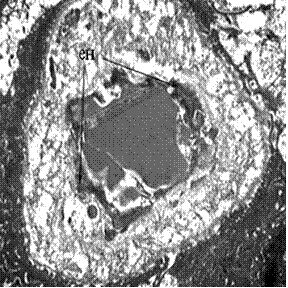
С одной стороны, ангиогенез действующий в местах атрофии, сопровождался образованием сосудов без признаков эндотелиальной дисфункции (рис. 2а). С другой - при наличии клеточных элементов с нативной ультраструктурой наблюдались значительные участки кости, которые имели признаки соединительной ткани, которая в основном из коллагеновых волокон, или хряща даже с признаками хондроптоза, остаточные включения соединительной ткани проявляли признаки активности (рис. 2б).
а
б
Рисунок 1 - Состояние альвеолярного отростка верхней челюсти через 6 месяцев после проведения синус-лифтинга (б); а - выраженная двусторонняя атрофия альвеолярного отростка верхней челюсти, вызванная частичной адонтиею, к костно-пластической операции. Стрелками обозначены участки атрофии или восстановления костной ткани.
В исследуемых образцах оказывались фибробласты, которые играют ведущую роль в синтезе компонентов межклеточного вещества: проколлагена и протеогликанов, которые повышают прочность соединительной ткани, а также фибронектина, эластина, гликозаминогликанов [2,10]. Фибробласты проявляли высокую активность, о чем можно было судить по хорошо выраженной зернистостью гранулярного эндоплазматического ретикулума, занимавший около 35-40% объема клетки (рис. 3). Обнаружен феномен может указывать на продолжение процесса ремоделирования кости.
а

б
Рисунок 2 - Ультраструктура костной ткани альвеолярного отростка верхней челюсти через 6 месяцев после проведения синус-лифтинга: а - отсутствие эндотелиальной дисфункции; б - прорастание компонентов межклеточного вещества и проявления хондроптоза. эн - эндотелий, К - коллагеновые волокна, Х - хондроптоз. х 9600
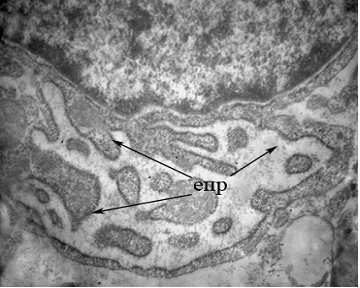
Рисунок 3 - Ультраструктура фибробласта в области проведения синус-лифтинга. х16200
Ультраструктура прикрепленной десны визуально приобретала нативный вид. Однако при проведении морфометрических исследований были выявлены различия ткани десен у пациентов от здоровых лиц: наблюдалась достоверно (на 18,8%) меньше количества функционирующих капилляров; определялось достоверное (на 30,5%) утолщение гистогематического барьера (ГГБ) в ткани десен; росло (на 34,7%) общее количество митохондрий (МХ) в исследуемой ткани (табл.).
Отмеченные особенности характеризуют как неполную завершенность процессов восстановления тканей пародонта через 6 месяцев после синус-лифтинга [3,18], так и указывают на различия структуры тканей пародонта у пациентов, альвеолярный отросток которых подвергался атрофии.
Таблица - Некоторые морфометрические характеристики ткани прикрепленной десны у пациентов через 6 месяцев после проведения синус-лифтинга (M ± m, n = 15 в каждой группе)
| Группы обследуемых | Количество функционирующих капиляров, Од/мм2 |
Толщина гистогематического барьера,
нм
|
Общее количество митохондрий, Од/мкм2 |
| Контрольная | 45,3±2,3 | 203±10 | 9,8±0,7 |
| Пациенты через 6 мес. после синус-лифтинга (до проведения имплантации) |
36,8±1,9*
|
265±12* |
13,2±0,7* |
Примечание: * - разница достоверна относительно контрольных величин (р <0,05).
Период регенерации альвеолярного отростка верхней челюсти сопровождался изменениями местной неспецифической резистентности у пациентов, через полгода после проведения синус-лифтинга отображалось в росте числа нейтрофилов, эмигрировавших через слизистую оболочку щеки и активности щелочной фосфатазы в них (рис. 4).
Патологические процессы, развивающиеся в организме, особенно те, которые связаны с патологией обменного характера, часто сопровождаются изменениями в морфофункциональном состоянии слизистой оболочки ротовой полости, которые оговариваются повреждениями сосудистой стенки [3,8], на что, в частности, указывает обнаруженная нами гипергидратация гистогематического барьера (более 30% его утолщение). Именно рост проницаемости сосудистой стенки приводит к выходу клеток из сосудистого русла в частности на поверхность щеки, что и отражается определенным увеличением количества нейтрофильных лейкоцитов (см. Рис. 4).
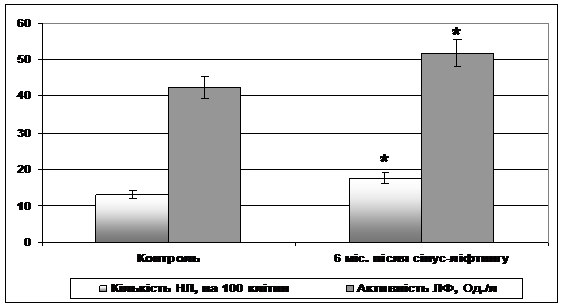
Рисунок 4 - Показатели местной неспецифической резистентности. * - Разница достоверна относительно контрольных значений (р <0,05).
В настоящее время показано, что щелочная фосфатаза относится к биохимическим маркерам обмена веществ в костной ткани [6]. Уровень ее активности характеризует дифференциацию гранулоцитов и является одним из ранних показателей функционирования остеобластов, принимает участие в процессах минерализации кости. Итак увеличение активности этого фермента (см. Рис. 4) может быть одним из свидетельств активного течения костной регенерации. Однако, если оценить соотношение активности щелочной фосфатазы к общему количеству нейтрофилов лейкоцитов, которые эмигрировали в ротовую полость, оказывается, что величина щелочной фосфатазы / нейтрофильных лейкоцитов у пациентов является уменьшенной по отношению к контрольным особам: 3,24 в контроле и 2,96 у лиц после синус-лифтинга. Установлено, что щелочная фосфатаза, которая определяется в нейтрофильных лейкоцитах, относится к танинонеспецифичным изомерам фермента, и ее активность возрастает в процессе костной дифференцировки [6,17]. Следовательно, при регенерации альвеолярного отростка после синус-лифтинга активность щелочной фосфатазы в каждом нейтрофиле должна расти. То есть, можно предположить, что определенный нами уровень соотношения исследуемых показателей указывает на снижение местной неспецифической резистентности и меньшую за необходимую эффективность протекания процессов регенерации костной ткани альвеолярного отростка верхней челюсти после проведения синус-лифтинга. Для подтверждения такого предположения можно привлечь результаты, полученные в исследованиях относительно соотношения нейтрофилов лейкоцитов и активности катионных белков в них при незавершенной или осложненной репаративной регенерации после хирургического лечения переломов челюстей [12].
Оценку общей неспецифической резистентности организма пациентов через 6 мес. после проведения синус-лифтинга осуществляли на основе исследования активности щелочной фосфатазы и ее костной изоформы - остазы в плазме больных.
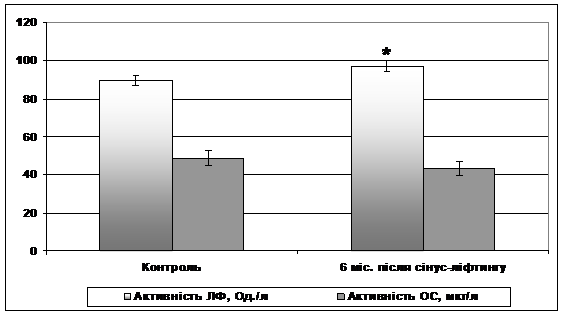
Рисунок 5 - Показатели общей неспецифической резистентности. * - Разница достоверна относительно контрольных значений (р <0,05).
У пациентов через 6 мес. после синус-лифтинга показано достоверное повышение активности щелочной фосфатазы в плазме крови (рис. 5). Такая динамика, учитывая роль фермента в регенерации кости, могла бы рассматриваться как положительный факт о ходе ремоделирования альвеолярного отростка. Однако, при этом известно, что существует корреляция между уровнем концентрации костная фракция щелочной фосфатазы - остазы, и скоростью формирования кости [2,10,17]. Считают, что у здоровых лиц соотношение общей щелочной фосфатазы и остазы составляет 43-55%. В обследованной нами контрольной группе соотношение остазы / щелочной фосфатазы составило 54,3%. У пациентов после синус-лифтинга, достоверных изменений активности Остазы плазмы крови не наблюдалось (см. Рис. 5), а соотношение остазы / щелочной фосфатазы даже несколько уменьшалось - до 44,5% за счет повышения общей активности щелочной фосфатазы, не отражает процессов активной регенерации костной ткани. Полученные результаты подтверждают имеющиеся в научной литературе данные, свидетельствующие о том, что через 4-6 мес. после синус-лифтинга костно-тканевой регенерат имеет неоднородное строение, которое указывает на продолжение регенеративных процессов [9].
Выводы.
- Через 6 месяцев после проведения синус-лифтинга с применением биоматериала BioOss пациентам с атрофией альвеолярного отростка верхней челюсти процессы репаративной регенерации не могут считаться полностью завершенным.
- Уровень активности щелочной фосфатазы и ее костной изоформы не указывает на эффективное ремоделирования кости, а последняя по своей структуре отличается от таковой у здоровых лиц.
- Наблюдается снижение местной и общей неспецифической резистентности у пациентов после проведения костно-пластической операции.
- Установленные факты необходимо учитывать при проведении направленных терапевтических мероприятий для повышения эффективности восстановления костной ткани и увеличение резерва общей и местной неспецифической резистентности в течение восстановительного периода после костно-пластических операций.

