Ультраструктура тканин пародонта верхньої щелепи та зміни деяких показників загальної та місцевої неспецифічної резистентності у пацієнтів через 6 місяців після проведення сінус-ліфтингу

На теперішній час розповсюдженими методами заміщення кісткового дефекту є синус-ліфтинг. Найчастіше він є необхідним для якісного встановлення зубних імплантатів у бічні відділи верхньої щелепи в умовах недостатнього об'єму кістки. Процеси остеорегенерації у пацієнтів з атрофією альвеолярного відростка верхньої щелепи, яким було проведено сінус-ліфтинг, з огляду на особливості і щільності будови кістки та інтенсивність кровопостачання кісткової тканини активно відбуваються протягом 6 місяців [1,3]. Вважають, що саме в цей період після остеозаміщення остеопластичним матеріалом практично завершується формування нової кістки, проростання капілярів та відновлення більшості гомеостатичних параметрів ротової порожнини [23]. Однак, говорити про те, що механізми, які відповідають за перебіг відновлюваних процесів, розкриті повністю на теперішній час є передчасним [18].
Протягом тривалого часу в клінічній практиці в якості кістково-пластичних матеріалів застосовувалися три види кісткових трансплантатів: аутогенні, алогенні й ксеногенні, котрі здатні забезпечувати направлену кісткову регенерацію [22]. У стоматологічній практиці часто застосовують натуральний остеозамінюючий матеріал Bio-Oss, який складається з мінеральних компонентів бичачої кістки. Дослідники та клініцисти вважають, що біоматеріали природного походження можуть справляти позитивний вплив на адгезію клітин, загоєння ран та регенерацію тканин, а також слугувати матрицею для нової тканини, що формується [20,23]. Проте на сьогоднішній день можна стверджувати, що ще не існує “ідеального матеріалу”, який би відповідав усім вимогам й повною мірою забезпечував неускладнений перебіг формування кістки.
Метою роботи було дослідження структури та функції тканин пародонта, місцевої неспецифічної резистентності в ротовій порожнині та активності лужної фосфатази у пацієнтів з атрофією альвеолярного відростка верхньої щелепи через 6 місяців після проведення сінус-ліфтингу.
Матеріали та методи дослідження.
З метою формування репрезентативної групи пацієнтів для виконання роботи проведено комплексне обстеження 127 осіб обох статей віком 35-55 років без пародонтиту або з пародонтитом І-го ступеня з атрофією альвеолярного відростка верхньої щелепи, викликаною екстракцією зубів. На ортопантомограмі виявляли часткову адентію без вогнищ хронічного периодонтиту але з вираженою деструкцію альвеолярного відростка верхньої щелепи в ділянці молярів (висота альвеолярного відростка становила здебільшого 2 - 4 мм).
Всім пацієнтам перед операцією сінус-ліфтингу, проводилася оцінка функціонального стану організму із застосуванням загальноприйнятих методів передопераційної підготовки. Рентгенологічне обстеження включало вивчення прицільних знімків щелепних сегментів, у тому числі оклюзійних ортопантомограм, яки проводили за допомогою цифрового ортопантомографа Planmeca ProOne (Фінляндія).
Реконструкцію альвеолярного відростка та тіла верхньої щелепи виконували доступом через дистально-латеральну стінку з підняттям дна верхньощелепної пазухи [13]. В якості кістково-пластичного матеріалу застосовували натуральний остеозамінюючий біоматеріал BioOss (Geistlich Biomaterials, Швейцарія) , який складається з мінеральних компонентів бичачої кістки і являє собою надійний каркас для проростання кровоносних судин та міграції остеобластів з кісткових стінок, котрі оточують кістковий дефект, що полегшує формування та проростання нової кістки [20,23].
У морфологічних і морфометричних дослідженнях використовували зразки прикріплених ясен та кістки верхньої щелепи. Препарати для електронномікроскопічних досліджень виготовляли за загальноприйнятою методикою з попередньою декальцинацією зразків кістки альвеолярного відростка [7]. Фіксацію біологічного матеріалу проводили за допомогою забуференого 2,5% розчину глютарового альдегіду та реактиву Колфілда (на основі 2% OsO4, pH – 7,3) з наступною заливкою в епон (реактиви фірми Sigma, США). Ультратонкі зрізи товщиною 40-60 нм контрастували з 1% розчином ураніл ацетату та розчином цитрату свинцю за методикою Рейнольдса (реактиви фірми Sigma, США) [15] і досліджували за допомогою електронного мікроскопа ПЕМ-125К (Україна).
Морфометричну оцінку гістогематичного бар'єра (ГГБ) у тканині прикріплених ясен виконували на електронних мікрофотографіях згідно з підходами Вейбеля [4], визначаючи середню арифметичну товщину бар’єру (τ). Загальну кількість функціонуючих капілярів визначали згідно з методикою Hoppeler H. та ін. [19] на екрані електронного мікроскопа при малому збільшенні (х 1800-2000). Загальну кількість мітохондрій (nМХ) визначали за допомогою комп'ютерної програми Image Tool Version 3 (США) на 130-150 полях для кожної серії досліджень.
Дослідження кількості нейтрофільних лейкоцитів (НЛ), котрі емігрували в ротову порожнину через слизову оболонку щоки, виконували у соскобах, відібраних згідно з методикою, запропонованою В.Д.Дишловим [5]. Соскоби (мазки) фіксували у метиловому спирті, фарбували розчином (1 мл готового фарбника + 2 мл основного буферного розчину + 47 мл дистильованої води) протягом 40 хв. Ядра нейтрофілів були пофарбовані у кольори від інтенсивно пурпурного до фіолетового, цитоплазма – у синьо-голубий колір [14,16]. Підраховували кількість нейтрофілів на 100 клітин за допомогою світлового мікроскопа (імерсія, х90) (Karl Zeiss, Германія).
Визначення активності лужної фосфатази (ЛФ) нейтрофільних лейкоцитів проводили методом азотсполучення із заміщенням нафтолом за Акерманом [5,11]. Для оцінки цитохімічної реакції застосовували метод Kaplow L.S. [26].
Визначення активності лужної фосфатази плазми крові визначали фотоколориметричним методом за допомогою фотоелектроколориметра (ФЕК - AE-30F, Росія) [11].
Кількісне визначення кісткового ізофермента лужної фосфатази – остази (ОС) для оцінки активності остеобластів, виконували у зразках плазми крові методом імуноферментного аналізу за допомогою наборів METRA® BAP (Quidel corporation, США). Вимірювання виконували планшетним фотометром для імуноферментного аналізу УНИПЛАН (ПІКОН, Росія).
Статистичний аналіз отриманих даних проводили з використанням пакета прикладних програм (пакет аналізу Мicrosoft Office Excel (2003)). При р<0,05 зміни вважали достовірними.
Результати дослідження та їх обговорення.
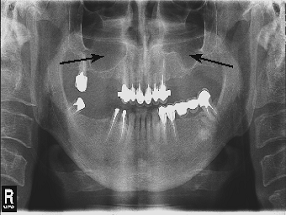
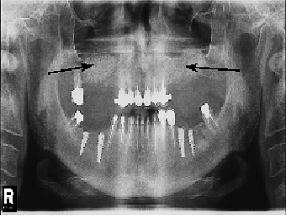
При аналізі ортопантомограм через 6 місяців після проведення сінус-ліфтингу в ділянках, у яких спостерігалася атрофія альвеолярного відростка верхньої щелепи, котра усувалася за допомогою біоматеріалу BioOss візуально визначалося ремоделювання кістки (Рис. 1б), тобто, через півроку після операції сінус-ліфтингу відбувалося відновлення альвеолярного відростка верхньої щелепи. Однак, структура регенерованої кістки не може вважатися повністю ідентичною кістці здорових осіб (Рис. 2).
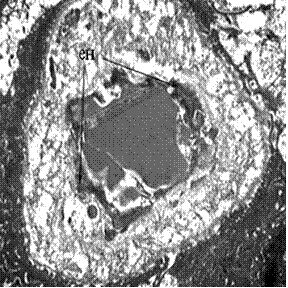
З одного боку, ангіогенез, активований в місцях атрофії, супроводжувався утворенням судин без ознак ендотеліальної дисфункції (Рис. 2а). З іншого - за наявності клітинних елементів з нативною ультраструктурою спостерігалися значні ділянки кістки, котрі мали ознаки сполучної тканини, яка складалася переважно з колагенових волокон, або хряща навіть з ознаками хондроптоза, залишкові включення сполучної тканини виявляли ознаки активності (Рис. 2б).
а
б
Рисунок 1 – Стан альвеолярного відростка верхньої щелепи через 6 місяців після проведення сінус-ліфтингу (б); а – виражена двостороння атрофія альвеолярного відростка верхньої щелепи, викликана частковою адонтією, до кістково-пластичної операції. Стрілками позначені ділянки атрофії або відновлення кісткової тканини.
В досліджуваних зразках виявлялися фібробласти, що відіграють провідну роль у синтезі компонентів міжклітинної речовини: проколагену та протеогліканів, які підвищують міцність сполучної тканини, а також фібронектину, еластину, глікозаміногліканів [2,10]. Фібробласти виявляли високу активність, про що можна було судити за добре вираженою зернистістю гранулярного ендоплазматичного ретикулуму, що займав близько 35-40% об'єму клітини (Рис. 3). Виявлений феномен може вказувати на продовження процесу ремоделювання кістки.
а

б
Рисунок 2 - Ультраструктура кісткової тканини альвеолярного відростка верхньої щелепи через 6 місяців після проведення сінус-ліфтингу: а – відсутність ендотеліальної дисфункції; б – проростання компонентів міжклітинної речовини та прояви хондроптоза. ен – ендотелій, К – колагенові волокна, Х – хондроптоз. х 9600
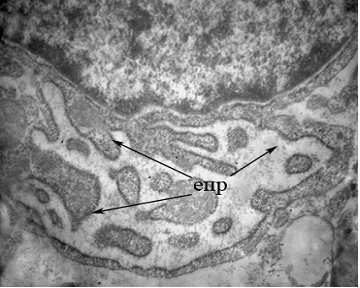
Рисунок 3 - Ультраструктура фібробласта в ділянці проведення сінус-ліфтингу. х16200
Ультраструктура прикріплених ясен візуально набувала нативного вигляду. Однак при проведенні морфометричних досліджень було виявлено відмінності тканини ясен у пацієнтів від здорових осіб: спостерігалася достовірно (на 18,8%) менша кількості функціонуючих капілярів; визначалося достовірне (на 30,5%) потовщення гістогематичного бар'єру (ГГБ) в тканині ясен; зростала (на 34,7%) загальна кількість мітохондрій (МХ) в досліджуваній тканині (Табл.).
Відмічені особливості характеризують як неповну завершеність процесів відновлення тканин пародонта через 6 місяців після сінус-ліфтингу [3,18], так і вказують на відмінності структури тканин пародонта у пацієнтів, альвеолярний відросток котрих піддавався атрофії.
Таблиця - Деякі морфометричні характеристики тканини прикріплених ясен у пацієнтів через 6 місяців після проведення сінус-ліфтингу (M±m, n=15 в кожній групі)
| Групи обстежених | Кількість функціонуючих капілярів, Од/мм2 |
Товщина гістогематичного бар'єра,
нм
|
Загальна кількість мітохондрій, Од/мкм2 |
|
Контрольна
|
45,3±2,3 |
203±10
|
9,8±0,7 |
| Пацієнти через 6 міс. після сінус-ліфтингу (до проведення імплантації) |
36,8±1,9*
|
265±12* | 13,2±0,7* |
Примітка: * - різниця достовірна відносно контрольних величин (р<0,05).
Період регенерації альвеолярного відростка верхньої щелепи супроводжувався змінами місцевої неспецифічної резистентності у пацієнтів, що через півроку після проведення сінус-ліфтингу відображалося у зростанні кількості нейтрофілів, які емігрували через слизову оболонку щоки і активності лужної фосфатази в них (Рис. 4).
Патологічні процеси, які розвиваються в організмі, особливо ті, що пов'язані з патологією обмінного характеру, часто супроводжуються змінами у морфофункціональному стані слизової оболонки ротової порожнини, котрі обумовлюються пошкодженнями судинної стінки [3,8], на що, зокрема, вказує виявлена нами гіпергідратація гістогематичного бар'єру (більш, ніж 30% його потовщення). Саме зростання проникності судинної стінки призводить до виходу клітин із судинного русла зокрема на поверхню щоки, що і відображається визначеним збільшенням кількості нейтрофільних лейкоцитів (див. рис. 4).
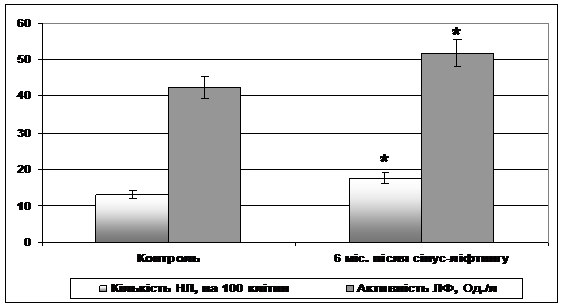
Рисунок 4 – Показники місцевої неспецифічної резистентності. * - різниця достовірна відносно контрольних значень (р<0,05).
На даний час показано, що лужна фосфатаза відноситься до біохімічних маркерів обміну речовин в кістковій тканині [6]. Рівень її активності характеризує диференціацію гранулоцитів і є одним з ранніх показників функціонування остеобластів, приймає участь в процесах мінералізації кістки. Отже збільшення активності цього ферменту (див. рис. 4) може бути одним із свідчень активного перебігу кісткової регенерації. Однак, якщо оцінити співвідношення активності лужної фосфатази до загальної кількості нейтрофільних лейкоцитів, котрі емігрували в ротову порожнину, виявляється, що величина лужної фосфатази / нейтрофільних лейкоцитів у пацієнтів є зменшеною по відношенню до контрольних осіб: 3,24 в контролі та 2,96 у осіб після сінус-ліфтингу. Встановлено, що лужна фосфатаза, яка визначається в нейтрофільних лейкоцитах, належить до танинонеспецифічних ізомерів ферменту, і її активність зростає в процесі кісткового диференціювання [6,17]. Отже, при регенерації альвеолярного відростка після сінус-ліфтингу активність лужної фосфатази в кожному нейтрофілі має зростати. Тобто, можна припустити, що визначений нами рівень співвідношення досліджуваних показників вказує на зниження місцевої неспецифічної резистентності та меншу за необхідну ефективність перебігу процесів регенерації кісткової тканини альвеолярного відростка верхньої щелепи після проведення сінус-ліфтингу. Для підтвердження такого припущення можна залучити результати, отримані в дослідженнях відносно співвідношення нейтрофільних лейкоцитів та активності катіонних білків в них при незавершеній або ускладненій репаративній регенерації після хірургічного лікування переломів щелеп [12].
Оцінку загальної неспецифічної резистентності організму пацієнтів через 6 міс. після проведення сінус-ліфтингу здійснювали на основі дослідження активності лужної фосфатази та її кісткової ізоформи – остази, в плазмі хворих.
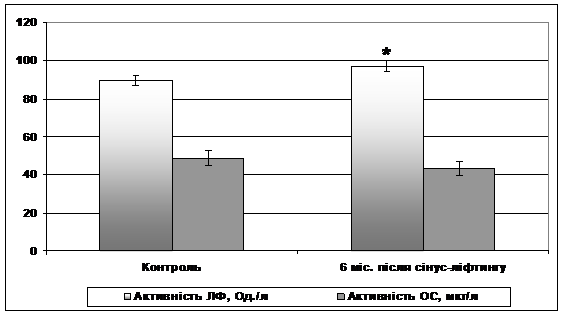
Рисунок 5 – Показники загальної неспецифічної резистентності. * - різниця достовірна відносно контрольних значень (р<0,05).
У пацієнтів через 6 міс. після сінус-ліфтингу показано достовірне зростання активності лужної фосфатази в плазмі крові (Рис. 5). Така динаміка, зважаючи на роль ферменту в регенерації кістки, могла б розглядатися як позитивний факт щодо перебігу ремоделювання альвеолярного відростка. Однак, при цьому відомо, що існує кореляція між рівнем концентрації кісткова фракція лужної фосфатази – остази, та швидкістю формування кістки [2,10,17]. Вважають, що у здорових осіб співвідношення загальної лужної фосфатази та остази становить 43-55%. У обстеженій нами контрольній групі співвідношення остази / лужної фосфатази становило 54,3%. У пацієнтів після сінус-ліфтингу, достовірних змін активності Остази плазми крові не спостерігалося (див. рис. 5), а співвідношення остази / лужної фосфатази навіть дещо знижуєвалося - до 44,5% за рахунок підвищення загальної активності лужної фосфатази, що не відображає процесів активної регенерації кісткової тканини. Отримані результати підтверджують наявні в науковій літературі дані, котрі свідчать про те, що через 4-6 міс. після сінус-ліфтингу кістково-тканинний регенерат має неоднорідну будову, яка вказує на продовження регенеративних процесів [9].
Висновки.
- Через 6 місяців після проведення сінус-ліфтингу із застосуванням біоматеріалу BioOss пацієнтам з атрофією альвеолярного відростка верхньої щелепи процеси репаративної регенерації не можуть вважатися повністю завершеними.
- Рівень активності лужної фосфатази та її кісткової ізоформи не вказує на ефективне ремоделювання кістки, а остання за своєю структурою відрізняється від такої у здорових осіб.
- Спостерігається зниження місцевої та загальної неспецифічної резистентності у пацієнтів після проведення кістково-пластичної операції.
- Встановлені факти необхідно враховувати при проведенні спрямованих терапевтичних заходів для підвищення ефективності відновлення кісткової тканини і збільшення резерву загальної та місцевої неспецифічної резистентності протягом відновлювального періоду після кістково-пластичних операцій.

